
LUDOVIC MARTINET
Paysage Cellulaire Cytotoxique Contrôlant Le Développement Du Myélome Et Le Résultat Clinique.
Malgré les progrès récents des options thérapeutiques, les patients atteints de myélome connaissent souvent de multiples rechutes, même après un traitement réussi. Des études récentes soulignent l’influence du microenvironnement immunitaire dans la pathogenèse de cette maladie. Les lymphocytes Natural killer (NK) et T CD8+ peuvent reconnaître et détruire les cellules malignes du myélome. Ce point a été corroboré par notre équipe en utilisant des souris transgéniques VK*MYC, le modèle murin de myélome le plus pertinent à l’heure actuelle. Dans ce modèle, les cellules NK et T CD8+ non seulement limitent le développement spontané du myélome in vivo, mais elles ont également un impact sur l’efficacité thérapeutique des chimiothérapie standard contre le myélome (Guillerey, Ferrari de Andrade et al. 2015). Ainsi, la compréhension des paramètres immunitaires associés au développement du myélome et au devenir clinique des patients pourrait permettre le développement de nouvelles immunothérapies pour limiter l’émergence de clones résistants du myélome.
Paysage immunitaire associé au développement et au devenir clinique du myélome multiple.
Les principales modifications des cellules NK et T CD8+ associées au développement et à l’évolution du myélome restent inconnues. Pour répondre à cette question, nous analysons actuellement au niveau de la cellule unique le paysage transcriptomique des cellules NK et T CD8+ infiltrant les lésions de myélome en utilisant la technologie CITE-seq. Ces résultats obtenus sur un nombre restreint de patients atteints de myélome seront ensuite généralisés et étendus par des analyses de cytométrie en flux et des tests fonctionnels in vitro sur des échantillons collectés en routine au laboratoire à différents stades du myélome : MGUS (stade prémalin), SMM (stade asymptomatique), Diagnostic et Rechute. L’impact clinique des populations et des marqueurs clés des cellules NK et T CD8+ sera ensuite examiné par cytométrie en flux sur des biobanques d’aspirats de moelle osseuse congelés prélevés au moment du diagnostic et de la rechute.
Modifications métaboliques contrôlant la surveillance immunitaire du myélome multiple
Il est maintenant clair que des dérégulations métaboliques peuvent être à l’origine du dysfonctionnement des lymphocytes infiltrant la tumeur. En effet, l’utilisation accrue de la glycolyse et de la phosphorylation oxydative (OxPHOS) par les cellules tumorales conduit souvent à une déplétion des nutriments essentiels, ainsi qu’à l’accumulation de métabolites immunosuppresseurs. Par conséquent, la fonctionnalité des cellules immunitaires peut être affectée non seulement par leurs altérations métaboliques intrinsèques, mais aussi par le milieu métabolique défavorable du microenvironnement tumoral. Cela pourrait être le cas dans le myélome, car nous avons récemment observé des altérations métaboliques dans les cellules NK de patients atteints de myélome par rapport aux cellules HD. Pourtant, jusqu’à présent, très peu d’informations sont disponibles sur les altérations métaboliques immunitaires dans la moelle osseuse des patients atteints de myélome.
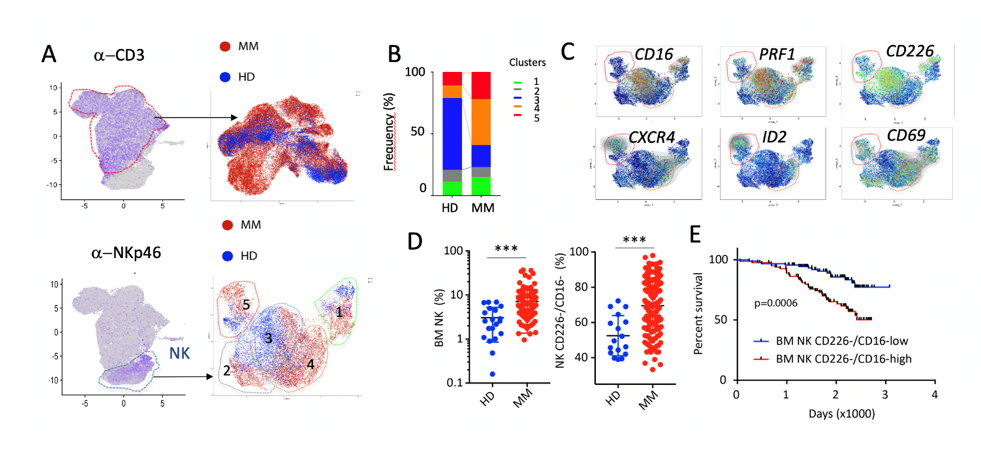
Figure 1 : Stratification and clinical outcome of MM patients according to cytotoxic cell landscape. (A). Identification of NK and CD3+ T cells on UMAPs calculated with CITE-seq data of paired Blood and BM samples from 4 HD and 4 MM patients at diagnosis. (B-C) T cell (B) and NK cell (C) clusters in the BM of MM and HD. (D) Relative frequency of MM and HD NK cells clusters. (E) Differentially expressed NK cell selected genes between MM and HD. (F) Relative frequency of BM NK cells and CD226-/CD16- NK cells in the IFM2009 (n=180) cohort compared to HD (n=20). (G). Survival estimates for MM patients with high (>median, red) or low (<median, blue) infiltration of CD226-/CD16- NK cells. Log-rank (Mantel-Cox) test.

