
Ludovic MARTINET
Mécanismes À L’origine Du Dysfonctionnement Des Cellules T Cytotoxiques Associées Aux Tumeurs.
Déverrouiller les freins des lymphocytes cytotoxiques par le blocage des points de contrôle immunitaires PD1 et CTLA-4 représente le traitement anticancéreux le plus efficace actuellement. Malheureusement, il devient évident que ces approches ne sont bénéfiques que pour un nombre limité de types de cancer et de patients. Par conséquent, trouver d’autres molécules qui limitent les réponses immunitaires anti-tumorales représente un enjeu majeur de santé publique.
L’inflammation dérégulée, un facteur clé de l’immunosuppression du myélome.
La croissance des cellules myélomateuses dépend fortement de la moelle osseuse, où les composants cellulaires et les facteurs solubles orchestrent en coopération un microenvironnement pro-survie et immunosuppresseur. Cependant, les mécanismes moléculaires et cellulaires de l’inflammation et de l’immunosuppression associées au myélome restent mal compris. En utilisant le modèle de souris préclinique Vk*MYC, une analyse complète du paysage transcriptionnel du microenvironnement immunitaire chez les patients atteints de myélome, nous avons récemment démontré que la production dérégulée d’IL-18 est un élément clé de l’immunosuppression dans le microenvironnement du myélome et une cible thérapeutique potentielle (Nakamura, Kassem et al. 2018). Nos résultats ont donc démontré que les cytokines pro-inflammatoires sont impliquées de manière critique dans la résistance du myélome multiple au système immunitaire, fournissant de nouvelles perspectives pour les stratégies thérapeutiques contre cette maladie. Une analyse complète des divers facteurs inflammatoires pouvvant modifier l’efficacité des cellules effectrices du système immunitaire est maintenant nécessaire.
La perte de CD226 restreint les fonctions anti-tumorales des lymphocytes T CD8+.
Les mécanismes qui sous-tendent le manque de réactivité des lymphocytes T CD8+ anti-tumoraux sont encore mal compris et la recherche de signaux supplémentaires qui régulent leurs fonctions est devenue une priorité majeure. Dans une étude récente, nous avons découvert que la perte du récepteur d’activation CD226 restreint les fonctions des cellules T CD8+ et l’efficacité thérapeutique de l’immunothérapie du cancer (Weulersse et al, immunité 2020). L’objectif de notre projet est maintenant d’utiliser des échantillons de patients atteints de cancer ainsi que les modèles de souris tumoraux les plus pertinents pour disséquer davantage le rôle moléculaire des récepteurs activateurs clés dans la signalisation du TCR CD8+, dans les réponses immunitaires anti-tumorales et dans l’efficacité de l’immunothérapie du cancer basée sur les anticorps monoclonaux.
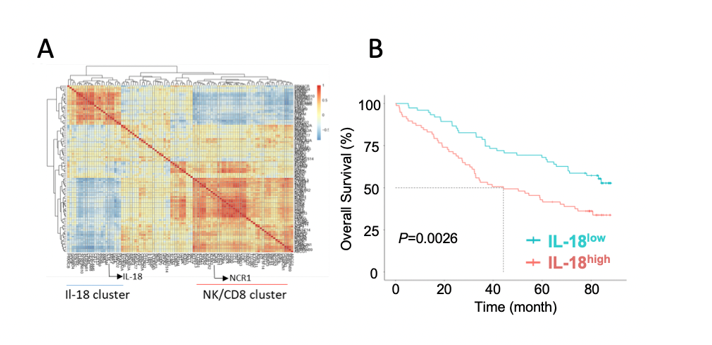
Figure 1 : Chronic inflammation as potential source of cytotoxic cell dysfunctions in MM. A. Heatmap showing the inverse correlation between IL-18 and NK/CD8 gene clusters within CD138– BM aspirates from 73 MM patients at diagnosis analyzed by RNA sequencing. B. Kaplan–Meier survival estimates over more than 80 months of follow-up for IL-18high (> median value) and IL-18low (< median value) MM patients.
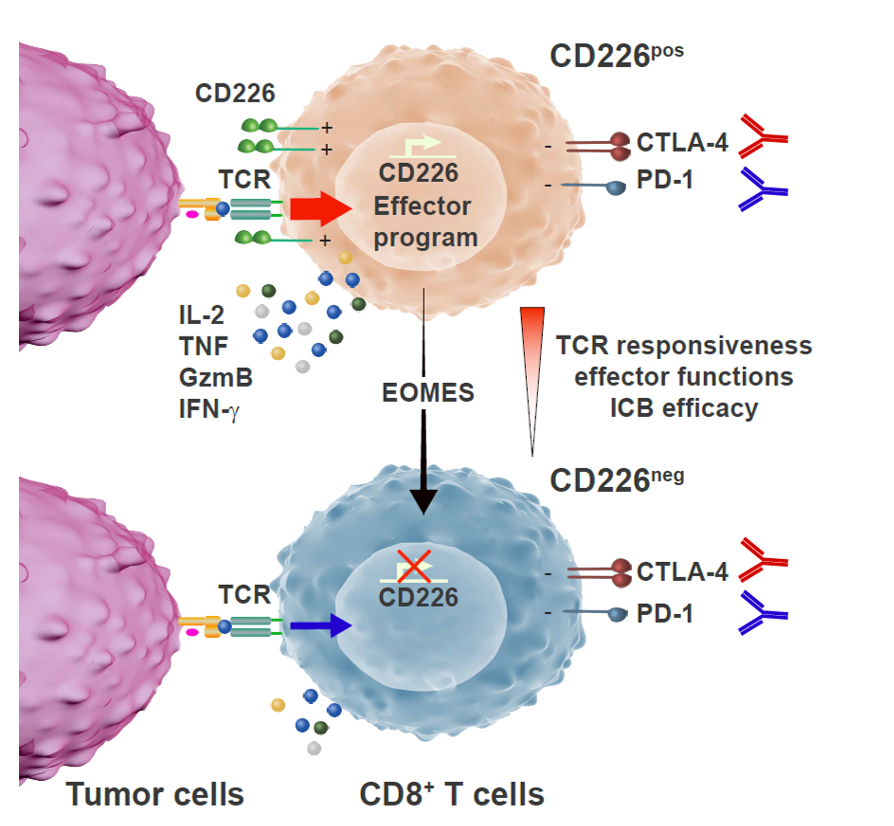
Figure 2 : the loss of the activating receptor CD226 restrains CD8+ T cell functions and the therapeutic efficacy of cancer immunotherapy.

