Les ARN non codant contre la résistance aux traitements des lymphômes T pédiatriques
Les lymphomes sont des cancers qui affectent les cellules du système immunitaire, c’est-à-dire les lymphocytes. Il s’agit de lymphocytes B ou T qui prolifèrent de façon incontrôlée au niveau des organes lymphatiques (ganglions, rate, thymus, amygdales…) ainsi qu’au niveau de territoires non lymphoïdes (tube digestif, peau, os, testicule, sein, œil, thyroïde…).
Les lymphomes se divisent en deux grandes catégories : le lymphome hodgkinien et le lymphome non hodgkinien. Chez les enfants de moins de 15 ans, le plus fréquent des lymphomes est de type « non-Hodgkinien » ou LNH. Chez les adolescents et les adultes, il s’agit plutôt de lymphome Hodgkinien.
Les LNH sont la 3ième cause de cancer chez l’enfant après les leucémies et les tumeurs cérébrales. Le lymphome anaplasique à grandes cellule (ou LAGC) est un LNH périphérique (en dehors du thymus) agressif développé à partir des lymphocytes T. Le LAGC est caractérisé par l’atteinte des ganglions lymphatiques périphériques, médiastinaux et abdominaux. Il se manifeste par l’augmentation du volume d’un ganglion lymphatique (ou adénopathie) non douloureux, surtout au niveau du cou ou des aisselles (ganglions lymphatiques axillaires). Des atteintes d’autres organes que les ganglions lymphatiques (on parle alors de sièges extraganglionnaires) sont également possibles dont les poumons, le foie, la moelle osseuse, les os, la peau. Le LAGC représente environ 15% des LNH chez les enfants et les jeunes adultes ce qui en fait le lymphome pédiatrique le plus fréquent. C’est un lymphome agressif qui aboutira au décès du patient en l’absence de traitement, en l’occurrence la chimiothérapie.
On classe les LAGC en fonction de la présence ou de l’absence d’un certain changement génétique dans les cellules du lymphome : des chromosomes échangent une partie de leur matériel génétique, en l’occurrence les 2e et 5e chromosomes. Ce changement génétique engendre la surproduction d’une protéine appelée kinase du lymphome anaplasique, ou ALK. Ce changement génétique n’est jamais observé dans des cellules normales. Il est donc spécifique des LAGC. Si le changement génétique ALK est présent, on dit que le LAGC est ALK positif (ALK+) Si ce changement génétique est absent, on dit que le LAGC est ALK négatif. Le sous-type ALK négatif est retrouvé plus souvent chez les patients plus âgés, à partir de l’âge de 40 ans.
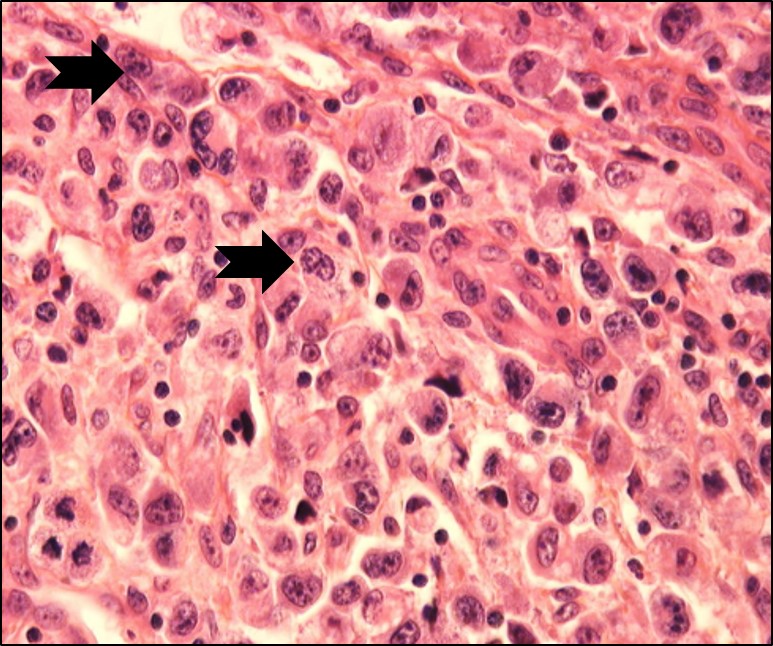
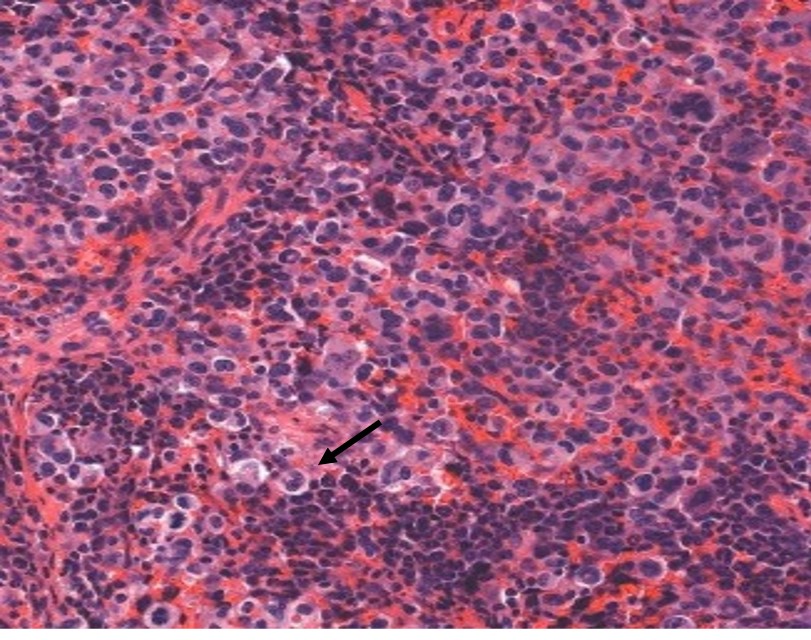
Lymphome anaplasique dans un ganglion lymphatique, constitué de grandes cellules caractéristiques avec un noyau souvent en fer à cheval (flèches)
Source de l’image : Pr. L. Lamant
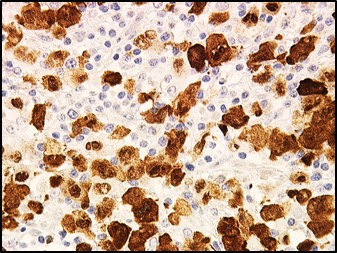
Dans la plupart des cas, la maladie est avancée quand on diagnostique le LAGC. La personne éprouve habituellement des symptômes, qui sont une fièvre, des sueurs nocturnes intenses et une perte de poids inexpliquée. Le diagnostic de la maladie est confirmé par les pathologistes. Ces médecins en réalisant l’examen histopathologique et immunohistochimique d’un fragment de la tumeur (ou biopsie) de ganglion lymphatique diagnostiquent le cancer. Les cellules tumorales caractéristiques du LAGC ALK(+), sont des cellules de grande taille, avec un noyau en forme de fer à cheval et exprimant la protéine ALK. Depuis plus de 20 ans, notre équipe est reconnue dans la caractérisation et l’identification des cellules cancéreuses spécifiques des LAGC ALK(+).
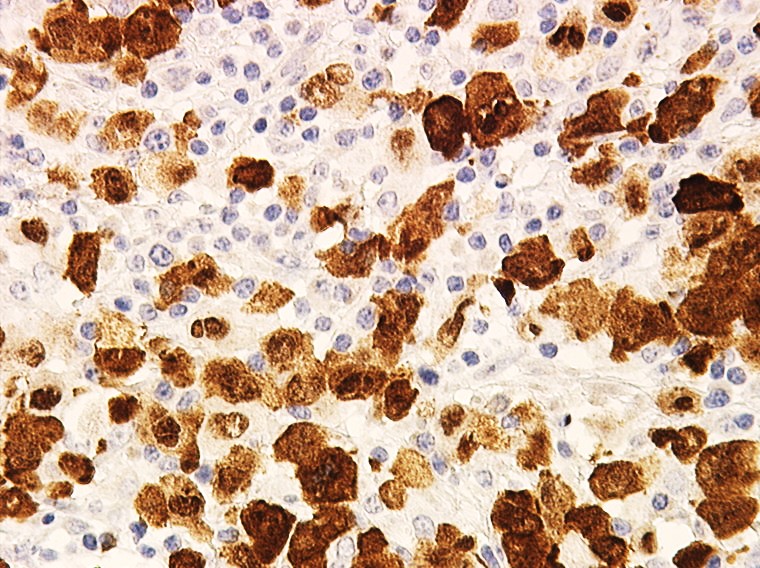
Les cellules cancéreuses expriment la protéine ALK suite à une anomalie génétique du chromosome 2 (cellules colorées en marron par technique immunohistochimique) ; cette positivité est synonyme de cancer car ALK n’est jamais exprimé par une cellule normale.
Source de l’image : Pr. L. Lamant
Les cellules qui constituent nos organes sont extrêmement nombreuses (plus de 50 000 milliards) et ont des fonctions très diversifiées (cellules nerveuses, cellules hépatiques (du foie), cellules de la peau, les lymphocytes…)! La plupart sont microscopiques (20 à 30 micromètres) et renferment une structure encore plus petite : le noyau. Chaque noyau contient le matériel génétique de la cellule, porté par les chromosomes. Etirés, ces longs bâtonnets en forme de X, permettraient d’obtenir une chaine de presque deux mètres de long qui n’est autre que l’ADN ! Chez l’Homme, chaque noyau contient 46 chromosomes — à l’exception des cellules sexuelles (spermatozoïdes et ovules produits pas les ovaires) qui n’en contiennent que 23. Déroulé et mis bout à bout, l’ADN constituant ces chromosomes dans les noyaux des 50 000 milliards de cellules représenterait plus de 130 fois la distance Terre-Soleil.
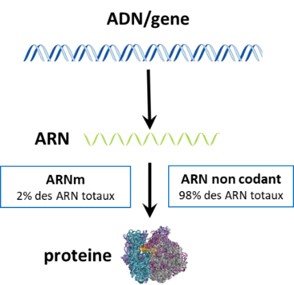 L’expression des gènes, encore appelée expression génique, désigne l’ensemble des processus par lesquels l’information héréditaire stockée dans un gène est « lue » pour aboutir à la fabrication de molécules qui auront un rôle actif dans le fonctionnement des cellules (ARN et protéines). Ainsi, dans le processus d’expression génique, les gènes présents sur l’ADN sont recopiés en molécules nommées ARN.
L’expression des gènes, encore appelée expression génique, désigne l’ensemble des processus par lesquels l’information héréditaire stockée dans un gène est « lue » pour aboutir à la fabrication de molécules qui auront un rôle actif dans le fonctionnement des cellules (ARN et protéines). Ainsi, dans le processus d’expression génique, les gènes présents sur l’ADN sont recopiés en molécules nommées ARN.
La famille des ARN est très vaste et peut être divisée en plusieurs sous familles dont :
- les ARN codant ou ARN messagers (ARNm) : le plus connu de nos jours est probablement celui que l’on trouve dans le vaccin anti-CoViD. Les ARNm sont impliqués dans la production des protéines c’est-à-dire de molécules biologiquement actives et présentes dans toutes les cellules vivantes. Toutefois, ils représentent moins de 3 à 5 % des molécules d’ARN dans la cellule.
- les ARN non codants, c’est-à-dire des ARN qui ne donneront pas de protéines et qui sont majoritaires dans une cellule. Ils peuvent être de petite taille, ce sont les microARN ou à l’inverse être longs et sont alors nommés longs ARN non codant
Longtemps sous-estimés car non impliqués dans la production de protéines, les ARN non codants sont aujourd’hui considérés comme des éléments clés contrôlant les processus cellulaires les plus fondamentaux. Ainsi, de plus en plus de preuves soutiennent l’hypothèse selon laquelle l’expression anormale des ARN non codant, principalement des microARN et des longs ARN non codants, peut modifier l’expression des gènes et être impliqués dans un large éventail de maladies humaines, telles que le cancer. Ainsi, ils peuvent être utilisés comme biomarqueurs pour le diagnostic et le pronostic de différentes maladies. Détectables dans les tissus ou les fluides (salive, urine, sérum ou sang encore appelés biopsies liquides), les ARN codants et non codant sont considérés comme des biomarqueurs de routine pour le diagnostic du cancer, la surveillance de la progression tumorale et la prédiction de la réponse aux traitements anti-cancéreux tels que la chimiothérapie (bonne réponse ou à l’inverse résistance). Le service de pathologie de IUCT Oncopole (cf ci-dessous), auquel le groupe de recherche notre rattaché, est notamment centre de référence français pour la recherche dans le sang et la moelle osseuse des ARNm à l’origine de l’expression de la protéine ALK dans tous les lymphomes anaplasiques ALK(+) de l’enfant et de l’adulte, avant et après chimiothérapie. La présence d’ARNm de ALK dans ces fluides avant le traitement mais également à la fin du traitement est considérée comme de mauvais pronostic et incite à continuer à traiter le patient, en changeant de traitement (arrêt de la chimiothérapie et mise en route d’un traitement anti-ALK appelé thérapie ciblée).
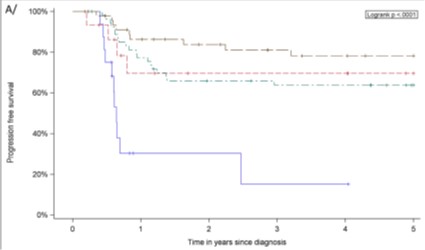
La courbe de survie des patients ayant des ARNm ALK dans leur sang ou moelle avant mais aussi après la chimiothérapie (courbe bleue) ont plus de risque de rechute que les autres (patients pédiatriques français porteurs d’un LAGC ALK+, traités par chimiothérapie entre 1999 et 2017) (voir article scientifique numéro 1).
Nos travaux de recherche sur les ARN non codant associés à la résistance des thérapies des LAGC ALK(+) de l’enfant sont développés au sein du Centre de Recherche en Cancérologie de Toulouse (ou CRCT ; https://www.crct-inserm.fr/). Ce centre de recherche dont le bâtiment est adossé à celui de l’hôpital nommé Institut Universitaire du Cancer (IUCT) accueille plusieurs équipes de recherche fondamentale et translationnelle, c’est-à-dire aux interfaces entre recherches fondamentale et clinique. Le CRCT est une Unité mixte de Recherche de l’Inserm (UMR 1037), du CNRS (UMR 5071) et de l’Université Toulouse III Paul Sabatier. Avec tous ses partenaires (institutionnels, universitaires, cliniques, industriels, caritatifs…), le CRCT stimule l’innovation en termes de recherche et d’enseignement dans la lutte contre le cancer. CRCT et IUCT sont localisés sur le site de l’Oncopole. Ce campus de cancérologie de Toulouse Oncopole, est un pôle de recherche sur le cancer à dimension européenne. Situé dans le sud de Toulouse, sur le site symbolique de l’explosion de l’usine AZF en 2001, le campus accueille des acteurs privés et publics dans le but d’harmoniser leur recherche pour la lutte contre le cancer.

L’oncopole accueille acteurs de soins, chercheurs, partenaires institutionnels, industriels, patients et familles. Objectifs : réunir et mobiliser les forces vives contre la maladie, travailler ensemble et optimiser le continuum prévention – recherche – soin.
Source image : https://www.oncopole-toulouse.com/fr/les-acteurs

L’Institut Universitaire du cancer localisé sur le site de l’Oncopole (IUCT-O) est un hôpital entièrement dédié au cancer

Au sein de l’Oncopole, le Centre de Recherche en cancérologie de Toulouse (CRCT) stimule l’innovation en termes de recherche et d’enseignement dans la lutte contre le cancer.
source https://www.crct-inserm.fr/
En laboratoire, les lymphocytes T normaux que l groupe de F. Meggetto forcent à exprimer la protéine ALK prennent l’apparence de cellules tumorales semblables aux cellules tumorales de patients atteints de LAGC ALK(+) (voir article scientifique numéro 2).
Source image : photothèque du CNRS (https://images.cnrs.fr/photo/20210031_0001)
Le traitement de référence du LAGC ALK(+) pédiatrique est une polychimiothérapie. Bien que les LAGC ALK(+) soient relativement sensibles à la chimiothérapie, environ 30% des jeunes patients rechutent précocement (cf courbe de survie plus haut) et ces rechutes sont toujours de très mauvais pronostic. Il est donc primordial de connaitre la genèse de ce cancer. En forçant des lymphocytes humains normaux à exprimer la protéine ALK, nous avons réussi à modéliser pour la première fois en laboratoire le LAGC ALK(+) (voir article scientifique numéro 2). En effet, les cellules normales exprimant la protéine ALK prennent l’apparence de cellules tumorales semblables aux cellules tumorales de patients atteints de LAGC ALK(+). Le séquençage à haut débit de tous les ARNm a montré que sous l’influence de ALK, les lymphocytes T normaux se transforment en cellules cancéreuses agressives exprimant des molécules
caractéristiques de cet état. Nos résultats ouvrent des perspectives pour l’étude des mécanismes à l’origine des rechutes observées après traitement. Ils renforcent également le fait que la recherche d’outils (biomarqueurs) pouvant prédire précocement les rechutes est primordiale pour ce cancer pédiatrique.
Afin de répondre à ce besoin, nous avons pour la première fois, réalisé le profil d’expression des microARN d’une cohorte de 80 échantillons de patients de LAGC ALK(+). En comparant nos résultats à ceux obtenus avec des ganglions non cancéreux, notre groupe est l’un des premier à avoir montré que dans les cellules de LAGC, plusieurs microARNs sont régulés négativement sous l’action de la protéine ALK. Ainsi, nous avons montré que :
- le microARN miR-16 stimule l’angiogenèse, c’est-à-dire le développement de nouveaux vaisseaux qui favorisent la croissance de la tumeur cancéreuse (article scientifique numéro 3).
- que la faible expression du microARN miR29a ou mi-R150 est associée à une diminution de la sensibilité des cellules ALK(+) à la chimiothérapie conventionnelle mais également à celle ciblant spécifiquement ALK (dite thérapie ciblée anti-ALK ou crizotinib) (voir articles scientifiques numéro 4 et 5).
- Nous avons montré que le mécanisme mis en place par miR-150 est annulé par un médicament déjà utilisé pour traiter le cancer. Ainsi au laboratoire, nous avons montré que des cellules cancéreuses résistantes à la thérapie ciblée anti-ALK deviennent sensibles sous l’action de cette drogue (voir article scientifique numéro 6).
- que le microARN miR-125b participe à la résistance à la chimiothérapie et qu’il pourrait servir de biomarqueur sanguin pour le suivi de la réponse au traitement (voir article scientifique numéro 7).
- que le microARN miR-497 inhibe la croissance des cellules tumorales en ciblant 3 trois régulateurs clés de la prolifération. En générant un système de notation basé sur l’expression de ces trois molécules/protéines, nous avons pu identifier de manière fiable les jeunes patients ayant rechuté précocément après chimiothérapie (voir article scientifique numéro 6).
Les microARN sont présents dans différents types de cellules et peuvent être sécrétés dans l’espace extracellulaire puis transportés dans les fluides corporels circulant comme le sang. Cependant, il a été rapporté que seulement 10% des microARN humains pouvaient être détectés dans le sang, probablement peut-être en raison d’un manque de stabilité, et environ 30% d’entre eux sont des formes peu représentées. Outre les microARN, une nouvelle classe de longs ARN non codants, les ARN circulaires (circARN), ont récemment attiré l’attention des biologistes spécialistes des ARN. Ces ARN sont organisés en une boucle fermée, ce qui augmente leur stabilité en les rendant insensibles à l’action d’enzyme dégradant les ARN linaires comme les microARN. Plusieurs études sur les circARN ont suggéré que ces molécules pourraient être des biomarqueurs importants dans les maladies humaines, en particulier le cancer. Ainsi, ils émergent déjà comme des outils pour prédire la résistance à la chimiothérapie de certaines tumeurs. Une meilleure compréhension de leur biologie pourrait également les placer comme de nouvelles cibles thérapeutiques innovantes.
L’utilisation de biomarqueurs s’est révélée être l’une des principales méthodes de diagnostic et de pronostic de diverses maladies telles que les cancers. Les caractéristiques d’un biomarqueur qualifié incluent la stabilité, la sensibilité, la spécificité, la précision et la reproductibilité. Actuellement, les circARN sont devenus les molécules les plus intéressantes en raison de leur abondance, de leur stabilité. En effet, de par leur structure, ils sont beaucoup plus stables que les ARN linéaires tels que les microARN. Ainsi, par rapport aux microARN, la population des circARN sanguins est plus grande et enrichie dans les fluides corporels dont le sang. Les biopsies « liquides » offrent dès lors de nombreux avantages : elles sont moins invasives que les prélèvements de tissus, elles permettent (dans un certain nombre de cas) d’affiner le diagnostic, de prédire et/ou de suivre la réponse au traitement, de diagnostiquer précocement l’apparition de métastases ou d’une résistance au traitement. Ainsi elles permettent des évaluations plus faciles et fréquentes avec moins de désagréments pour les patients que les biopsies conventionnelles effectuées par imagerie sur les organes malades. Il existe donc une tendance croissante à identifier des biomarqueurs circulants appropriés pour la biopsie liquide. Il est aujourd’hui établi que les circRNA peuvent être détectés facilement par PCR, une technique aujourd’hui utilisée en routine dans les laboratoires de biologie et permettre un diagnostic précoce, une sélection de thérapie appropriée, un pronostic précis et une surveillance thérapeutique fréquente. Les travaux actuels de notre groupe de recherche ont pour objectifs de déterminer si les circARN pourraient être utilisés comme biomarqueurs pronostiques / prédictifs circulants de la résistance des lymphomes LAGC ALK (+) de l’enfant et s’ils peuvent ouvrir de nouvelles voies de traitement dans l’objectif d’éviter les rechutes aux traitements classiques.
Les cellules LAGC expriment la protéine ALK suite à la translocation t(2 ;5) (coloration marron par technique immunohistochimique) ; cette positivité est spécifique des LAGC NPM-ALK(+) car jamais retrouvée dans une cellule normale.
Source de l’image : Pr. L. Lamant ; IUCT-Oncopole, service d’anatomopathologie
articles scientifiques publiés par le groupe de Fabienne Meggetto.
- Rigaud C, Abbas R, Grand D, Minard-Colin V, Aladjidi N, Buchbinder N, Garnier N, Plat G, Couec ML, Duplan M, Lambilliotte A, Schmitt C, Leblanc T, Lamant L, Brugières L, 2021, Pediatric Blood and Cancer, 68(6):e28982.
- Congras A, Hoareau-Aveilla C, Caillet N, Tosolini M, Villarese P, Cieslak A, Rodriguez L, Asnafi V, Macintyre E, Egger G, Brousset P, Lamant L, Meggetto F. ALK-transformed mature T lymphocytes restore early thymus progenitor features. 2020. Journal of Clinical Investigation;130(12):6395-6408.
- Dejean E., M.H. Renalier, M. Foisseau, X. Agirre, GR. de Paiva, T. Al Saati, J. Soulier, C. Desjobert, L. Lamant, F. Prósper, DW. Felsher, J. Cavaillé, Prats, S. Giuriato, F. Meggetto. MicroRNA-16 down-regulation induces VEGF expression in anaplastic lymphoma kinase (ALK) positive anaplastic large-cell lymphoma. 2011, Leukemia, 25(12):1882-1890.
- Desjobert C., MH. Renalier, J. Bergalet, N. Joseph, A. Kruzincsky, J. Soulier, E. Dejean, E. Espinos, F. Meggetto, J. Cavaillé, G. Delsol, L. Lamant. MiR-29a downregulation in ALK-positive Anaplastic Large Cell Lymphomas participates to apoptosis blockade through Mcl-1 overexpression. 2011, Blood, 117(24):6627-6637.
- Hoareau-Aveilla C, Quelen C, Congras A, Caillet N, Labourdette D, Dozier C, Brousset P, Lamant L, Meggetto F. MiR-497 suppresses cycle progression through an axis involving CDK6 in ALK-positive cells. 2018, Haematologica. 104(2):347-359.
- Hoareau-Aveilla ; T. Valentin; C. Daugrois ; C. Quelen; G. Mitou; S. Quentin; J. Jia; S. Spicuglia; P. Ferrier; S. Giuriato; P. Brousset ; L. Lamant; F. Meggetto. Reversal of microRNA-150 silencing disadvantages the growth of the Crizotinib-resistant NPM-ALK-positive cells. 2015, Journal of Clinical Investigation, 1;125(9):3505-18.
- Congras A, Caillet N, Torossian N, Quelen C, Brousset P, Lamant L, Meggetto F, Hoareau-Aveilla C. Doxorubicin-induced loss of DNA topoisomerase II and DNMT1-dependent suppression of MiR-125b induces chemoresistance in ALK-positive cells. 2018, 8;9(18):14539-51.A.
Ils participent à la recherche contre les cancers pédiatriques
au sein de l’équipe R’n Blood – Groupe de Fabienne Meggetto.

Fabienne Meggetto
DR CNRS
Scientifique

Laurence Lamant
Pr en Médecine
Anotomo-Pathologiste

Loélia Babin
Chercheur Post-Doctorante
Scientifique

Chloé Bessière
Chercheur Post-Doctorante
Bio-Informaticienne

Steffen Fuchs
Chercheur Post-Doctorant
Médecin oncopédiatre

Elissa Andraos
Etudiante en thèse
Scientifique

Centre de Recherches contre le Cancer de Toulouse (Oncopole)
Toulouse - FR
Suivez nous sur les réseaux sociaux
Nous contacter
+33 5 82 74 15 75
Nous rejoindre ?



