Cassures de l’ADN transcriptionnelles et maladies humaines
Olivier Sordet
Notre domaine de recherche
Les objectifs de notre recherche sont de comprendre comment la transcription, qui est un processus cellulaire essentiel, peut menacer l’intégrité du génome dans le contexte de problèmes topologiques de l’ADN et de connaître son impact sur l’étiologie et le traitement des maladies humaines. Lorsqu’elles transcrivent, les ARN polymérases induisent des torsions de l’ADN dont le défaut d’élimination peut favoriser la formation de cassures de l’ADN. Le tableau qui se dessine est que les cassures de l’ADN associées à la transcription sont étroitement liées à la formation de structures secondaires de l’ADN, telles que les R-loops et les G quadruplexes (G4) (Figure 1). Cependant, les connexions entre la transcription, la torsion de l’ADN et les structures secondaires de l’ADN dans la formation de cassures de l’ADN sont peu comprises. Notre groupe a pour objectif d’élucider ces connexions afin de mieux comprendre la façon dont la transcription menace l’intégrité du génome et son lien avec les maladies humaines.
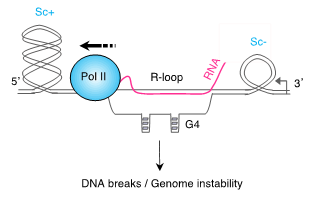
Figure 1. Connexions entre la transcription, la torsion de l’ADN (Sc : super-enroulement de l’ADN) et les structures secondaires de l’ADN (R-loop, G4) dans la formation de cassures de l’ADN.
Questions soulevées
Comment la transcription induit-elle des cassures de l’ADN dans le contexte de la topologie de l’ADN et des structures secondaires de l’ADN ?
Parmi les lésions génomiques, les cassures double-brin (DSB) de l’ADN sont peu fréquentes mais parmi les plus dangereuses. Les cassures double-brin associées à la transcription sont particulièrement risquées car elles se produisent dans des régions transcrites, et donc potentiellement sur des gènes impliqués dans des maladies, aussi bien dans les cellules qui se divisent que dans celles qui ne se divisent pas. Nos travaux antérieurs ont permis d’identifier un mécanisme de formation des DSB dans les cellules non réplicatives qui dépend strictement de la transcription et qui implique à la fois les contraintes topologiques de l’ADN et les R-loops (Sordet et al, EMBO Rep 2009 ; Cristini et al, Nucleic Acids Res 2016, Cell Rep 2019). Dans les cellules cancéreuses humaines, nous avons également montré, en collaboration avec Giovanni Capranico (Bologne, Italie), l’interaction entre les R-loops et les G4 dans l’induction de DSB (De Magis et al, PNAS 2019). Notre objectif est de caractériser l’étendue des connexions entre la torsion et les structures secondaires de l’ADN dans la formation et la réparation des cassures de l’ADN associées à la transcription.
Quelle est la contribution des cassures transcriptionnelles de l’ADN dans les maladies humaines ?
À mesure que nous comprenons comment la transcription peut compromettre l’intégrité du génome, il apparaît que le lien entre la transcription et l’étiologie/le développement des maladies humaines est beaucoup plus important que nous ne le pensions (voir nos revues récentes : Cristini et al, Mol Cell Oncol 2020, Int Rev Cell Mol Biol 2021). Par exemple, nous avons montré que plusieurs défauts génétiques qui augmentent les DSB transcriptionnelles provoquent également des maladies neurologiques (Cristini et al, Cell Rep 2019). Nous nous concentrons maintenant plus spécifiquement sur le rôle de la transcription dans l’instabilité du génome des cellules cancéreuses et son impact sur le développement et le traitement de la maladie.
Méthodes utilisées
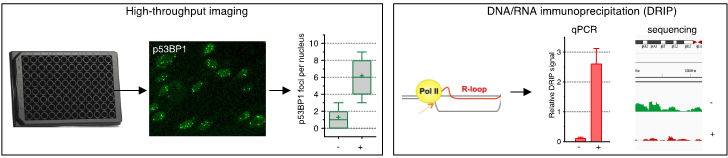
Nous utilisons des modèles de cellules réplicatives et non réplicatives couplés à des techniques de pointe pour analyser la transcription, les structures secondaires de l’ADN et les dommages à l’ADN au niveau de la cellule et du génome. Ces techniques incluent l’imagerie à haut débit, la ChIP et la DRIP (Figure 2). Nous utilisons également la technologie CRISPR pour introduire dans nos modèles cellulaires des défauts génétiques retrouvés dans les maladies humaines.
Mots clés:
- Cancer;
- Cassures de l’ADN;
- Topologie de l’ADN;
- Instabilité du génome;
- G-quadruplexes;
- Maladies humaines;
- Translocation oncogénique;
- R-loop;
- ARN polymérase;
- Hybride ARN/ADN;
- Topoisomérase;
- Transcription.
Membres du groupe
- Agnese Cristini (Ph.D.), Post-doc
- Mathéa Géraud (Pharm. D.), Doctorante
- Lara Fernandez-Martinez, Doctorante
- Latré Eustachia Lawson-body, Etudiante en Master2
Autres membres de l’équipe impliqués
- Anne Pradines (Chercheur)
- Julien Mazières (PU, PH)
- Estelle Taranchon-Clermont (Ingénieur)
Principales collaborations externes
- Giovanni Capranico, Université de Bologne, Italie
- Béatrice Eymin, Université de Grenoble, France
- Yves Pommier, NCI/NIH, Bethesda, USA
Publications sélectionnées
Int Rev Cell Mol Biol. 2021 Sep 12;364:195-240.doi: 10.1016/bs.ircmb.2021.05.001. PMID: 34507784.
Cristini A*, Géraud M, Sordet O*.
Transcription-associated DNA breaks and cancer: A matter of DNA topology.
*Co-corresponding authors.
Cell Rep. 2019 Sep 17;28(12):3167-3181.e6. doi: 10.1016/j.celrep.2019.08.041. PMID: 31533039
Cristini A, Ricci G, Britton S, Salimbeni S, Huang SN, Marinello J, Calsou P, Pommier Y, Favre G, Capranico G, Gromak N*, Sordet O*. Dual Processing of R-Loops and Topoisomerase I Induces Transcription-Dependent DNA Double-Strand Breaks.
*Co-corresponding authors.
Proc Natl Acad Sci USA. 2019 Jan 15;116(3): 816-825. doi: 10.1073/pnas.1810409116. PMID: 30591567
De Magis A, Manzo SG, Russo M, Marinello, Morigi R, Sordet O, Capranico G.
DNA damage and genome instability by G-quadruplex ligands are mediated by R-loops in human cancer cells.
Nucleic Acids Res. 2016 Feb 18;44(3):1161-78. doi: 10.1093/nar/gkv1196. PMID: 26578593
Cristini A, Park JH, Capranico G, Legube G, Favre G, Sordet O.
DNA-PK triggers histone ubiquitination and signaling in response to DNA double-strand breaks produced during the repair of transcription-blocking topoisomerase I lesions.
EMBO Rep. 2009 Aug;10(8):887-93. doi: 10.1038/embor.2009.97. PMID: 19557000
Sordet O, Redon CE, Guirouilh-Barbat J, Smith S, Solier S, Douarre C, Conti C, Nakamura AJ, Das BB, Nicolas E, Kohn KW, Bonner WM, Pommier Y.
Ataxia telangiectasia mutated activation by transcription- and topoisomerase I-induced DNA double-strand breaks.